Hipotiroidismul. Tot ce trebuie să știți despre hipotiroidism
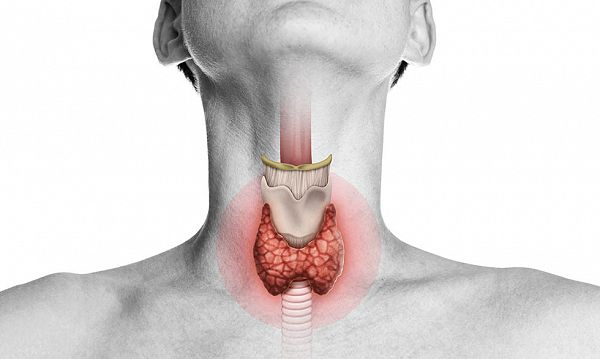
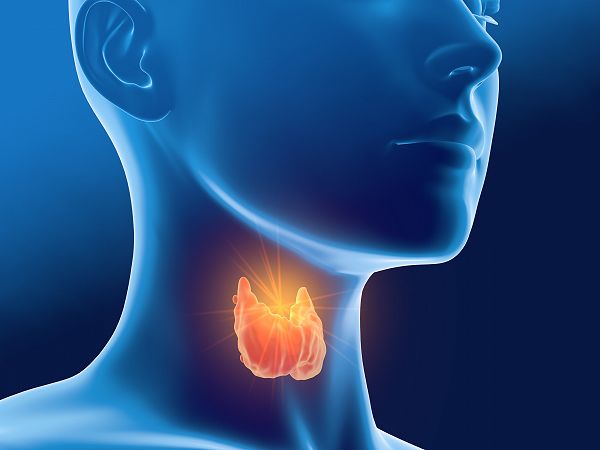
Ce este hipotiroidismul?Hipotiroidismul apare atunci când organismul dumneavoastră nu produce suficienți hormoni tiroidieni. Tiroida este o glandă mică, în formă de fluture, care se află în partea din față a gâtului dumneavoastră. Aceasta eliberează hormoni pentru a ajuta organismul dumneavoastră să regleze și să utilizeze energia.
Tiroida este responsabilă pentru furnizarea de energie pentru aproape fiecare organ din corpul dumneavoastră.
Ea controlează funcții precum modul în care bate inima dumneavoastră și cum funcționează sistemul digestiv. Fără cantitatea potrivită de hormoni tiroidieni, funcțiile naturale ale organismului dumneavoastră încep să încetinească.
Numit și hipotiroidie hipoactivă, hipotiroidismul afectează mai frecvent femeile decât bărbații.
Afectează în mod obișnuit persoanele cu vârsta de peste 60 de ani, dar poate începe la orice vârstă.
Poate fi descoperit printr-un test de sânge de rutină sau după ce încep simptomele.
Hipotiroidismul subclinic este numele dat unei forme timpurii, ușoare a afecțiunii.
Dacă ați fost diagnosticat recent cu hipotiroidism, este important să știți că tratamentul este considerat simplu, sigur și eficient.
Cele mai multe tratamente se bazează pe suplimentarea nivelurilor tale scăzute de hormoni cu hormoni artificiali.
Acești hormoni vor înlocui ceea ce corpul dumneavoastră nu produce singur și vor ajuta la revenirea la normal a funcțiilor organismului dumneavoastră.
Cât de frecvent este hipotiroidismul?Hipotiroidismul este o afecțiune destul de frecventă. Aproximativ 4,6% dintre americanii cu vârste de 12 ani și peste au hipotiroidism. În general, aproximativ 10 milioane de persoane din Statele Unite trăiesc cu această afecțiune.
Boala devine mai frecventă odată cu vârsta. Persoanele de peste 60 de ani se confruntă mai frecvent cu ea.
Femeile sunt mai predispuse să aibă o tiroidă hipoactivă.
De fapt, 1 din 8 femei va dezvolta hipotiroidism.
Care sunt semnele și simptomele hipotiroidismului?Semnele și simptomele hipotiroidismului variază de la o persoană la alta.
Gravitatea afecțiunii afectează, de asemenea, ce semne și simptome apar și când apar.
De asemenea, simptomele sunt uneori dificil de identificat.Primele simptome pot include creșterea în greutate și oboseala.
Ambele devin mai frecvente pe măsură ce îmbătrânești, indiferent de sănătatea tiroidei tale.
Este posibil să nu vă dați seama că aceste schimbări sunt legate de tiroida dumneavoastră până când apar mai multe simptome.
Cele mai frecvente semne și simptome ale hipotiroidismului includ:
- oboseală
- creșterea în greutate
- față umflată, sensibilă
- depresie
- constipație
- senzație de frig
- scăderea transpirației
- ritm cardiac încetinit
- colesterol ridicat în sânge
- piele uscată
- păr uscat și subțire
- tulburări de memorie
- dificultăți de fertilitate sau modificări menstruale
- slăbiciune musculară
- rigiditate, dureri și sensibilitate musculară
- durere și rigiditate la nivelul articulațiilor
- răgușeală
La majoritatea oamenilor, simptomele bolii evoluează treptat, pe parcursul mai multor ani.
Pe măsură ce tiroida încetinește din ce în ce mai mult, simptomele pot fi identificate mai ușor.
Desigur, multe dintre aceste simptome devin, de asemenea, mai frecvente odată cu vârsta în general.
Dacă bănuiți că simptomele dumneavoastră sunt rezultatul unei probleme tiroidiene, discutați cu medicul dumneavoastră.
Acesta poate recomanda un test de sânge pentru a determina dacă aveți hipotiroidism.
Care sunt cauzele hipotiroidismului?Cauzele comune ale hipotiroidismului sunt descrise mai jos.
Tiroidita HashimotoSistemul dumneavoastră imunitar este conceput pentru a proteja celulele organismului împotriva bacteriilor și virușilor invadatori.
Atunci când bacterii sau viruși necunoscuți pătrund în corpul dumneavoastră, sistemul imunitar răspunde trimițând celule de luptă pentru a distruge celulele străine. Uneori, organismul dumneavoastră confundă celulele normale, sănătoase, cu celulele invadatoare. Acest lucru se numește răspuns autoimun. Dacă răspunsul autoimun nu este reglat sau tratat, sistemul dumneavoastră imunitar poate ataca țesuturile sănătoase.
Acest lucru poate cauza probleme medicale grave, inclusiv afecțiuni precum hipotiroidismul.
Tiroidita Hashimoto este o afecțiune autoimună și cea mai frecventă cauză a unei tiroide hipoactive în Statele Unite.
Această boală vă atacă glanda tiroidă și provoacă o inflamație cronică a tiroidei.
Inflamația poate reduce funcția tiroidiană.
Afectează cel mai frecvent femeile de vârstă mijlocie, dar poate apărea la bărbați și copii. Această afecțiune se întâlnește, de asemenea, în familii. Dacă un membru al familiei a fost diagnosticat cu această boală, atunci riscul ca dumneavoastră să o aveți este mai mare.
Tratamentul pentru hipertiroidism
Dacă glanda dvs. tiroidă produce prea mulți hormoni tiroidieni, aveți o afecțiune cunoscută sub numele de hipertiroidism.
Tratamentul pentru această afecțiune are ca scop reducerea și normalizarea producției de hormoni tiroidieni.
Uneori, tratamentul poate face ca nivelurile hormonului tiroidian să rămână scăzute permanent. Acest lucru se întâmplă adesea după tratamentul cu iod radioactiv.
Îndepărtarea chirurgicală a tiroidei dvs.
Dacă întreaga glandă tiroidă este îndepărtată ca urmare a problemelor tiroidiene, veți dezvolta hipotiroidism.
Utilizarea medicamentelor pentru tiroidă pentru tot restul vieții este tratamentul principal. Dacă este îndepărtată doar o parte a glandei, este posibil ca tiroida dvs. să fie în continuare capabilă să producă suficienți hormoni pe cont propriu.
Testele de sânge vor ajuta la determinarea cantității de medicamente pentru tiroidă de care veți avea nevoie.
RadioterapieDacă ați fost diagnosticat cu cancer la cap sau la gât, limfom sau leucemie, este posibil să fi fost supus la radioterapie. Radiațiile utilizate pentru tratamentul acestor afecțiuni pot încetini sau opri producția de hormoni tiroidieni. Acest lucru va duce aproape întotdeauna la hipotiroidism.
Care sunt factorii de risc pentru hipotiroidism?Factorii care pot crește riscul de a dezvolta hipotiroidism includ:
- faptul că sunteți femeie
- vârsta de cel puțin 60 de ani
- antecedente familiale de hipotiroidism
- să aveți anumite afecțiuni autoimune, cum ar fi sindromul Sjögren și diabetul de tip 1
Cum se diagnostichează hipotiroidismul?Două instrumente principale sunt folosite pentru a determina dacă aveți hipotiroidism, o evaluare medicală și
testele de sânge.Evaluarea medicală
Medicul dumneavoastră va efectua un examen fizic complet și un istoric medical. Ei vor verifica dacă există semne fizice de hipotiroidism, inclusiv:
piele uscată
reflexe încetinite
umflături la nivelul gâtului
un ritm cardiac mai lent
În plus, medicul vă va cere să raportați orice simptome pe care le-ați avut, cum ar fi oboseala, depresia, constipația sau senzația constantă de frig.
Dacă aveți un istoric familial cunoscut de afecțiuni tiroidiene, spuneți-i medicului dumneavoastră în timpul acestui examen.
Teste de sângeTestele de sânge sunt singura modalitate de a confirma în mod fiabil un diagnostic de hipotiroidism.
Un test pentru
hormonul de stimulare a tiroidei (TSH) măsoară cantitatea de
TSH pe care o creează glanda ta hipofizară:
Dacă tiroida dumneavoastră nu produce suficienți hormoni, glanda pituitară va crește
TSH pentru a crește producția de hormoni tiroidieni.
Dacă aveți hipotiroidism, nivelul
TSH va fi ridicat, deoarece organismul dumneavoastră încearcă să stimuleze mai multă activitate a hormonilor tiroidieni.
Dacă aveți hipertiroidism, nivelurile
TSH vor fi scăzute, deoarece organismul dumneavoastră încearcă să oprească producția excesivă de hormoni tiroidieni.
Un test al
nivelului de tiroxină (T4) este, de asemenea, util în diagnosticarea hipotiroidismului.
T4 este unul dintre hormonii produși direct de tiroida dumneavoastră.
Folosite împreună, testele
T4 și TSH ajută la evaluarea funcției tiroidiene.
În mod obișnuit, dacă aveți un nivel scăzut de T4 împreună cu un nivel ridicat de TSH, aveți hipotiroidism. Cu toate acestea, există un spectru de boli tiroidiene. Este posibil să fie necesare și alte teste ale funcției tiroidiene pentru a vă diagnostica corect afecțiunea.
Care sunt complicațiile hipotiroidismului?Complicațiile hipotiroidismului includ:
gușă
leziuni nervoase
neuropatie periferică
sindromul de tunel carpian
reducerea funcției renale, în cazurile de boală severă
comă mixedemică, în cazurile de boală severă
apnee obstructivă în somn
Hipotiroidismul poate duce, de asemenea, la infertilitate sau la complicații legate de sarcină, cum ar fi preeclampsia.
Care sunt câteva sfaturi pentru a face față hipotiroidismului?
Chiar dacă urmați un tratament, este posibil să vă confruntați cu probleme sau complicații de lungă durată din cauza acestei afecțiuni. Cu toate acestea, există modalități de a diminua efectul hipotiroidismului asupra calității vieții dumneavoastră.
Monitorizați alte afecțiuni de sănătate
Există o legătură între alte boli autoimune și hipotiroidism. Hipotiroidismul merge adesea împreună cu alte afecțiuni, cum ar fi:
boala celiacă
diabet
poliartrită reumatoidă (AR)
lupus
tulburări care afectează glanda suprarenală
probleme hipofizare
Care este legătura dintre hipotiroidism și depresie?Atunci când nivelul de hormoni tiroidieni este scăzut, funcțiile naturale ale organismului încetinesc și întârzie. Acest lucru cauzează o varietate de simptome, inclusiv oboseală, creștere în greutate și chiar depresie. Un studiu din 2016 a constatat că 60% dintre persoanele cu hipotiroidism prezentau unele simptome de depresie.Unele persoane cu hipotiroidism pot avea doar dificultăți de dispoziție. Acest lucru poate face ca diagnosticarea hipotiroidismului să fie dificilă. În loc să trateze doar creierul, medicii ar trebui să ia în considerare și testarea și tratarea unei tiroide hipoactive.
Depresia și hipotiroidismul au în comun mai multe simptome. Acestea includ:
- oboseală
- creșterea în greutate
- dispoziție depresivă
- dorință și satisfacție reduse
- dificultăți de concentrare
- dificultăți de somn
Cele două afecțiuni au, de asemenea, simptome care le pot deosebi una de cealaltă.
În cazul hipotiroidismului, probleme precum pielea uscată, constipația, colesterolul ridicat și căderea părului sunt frecvente.
În cazul depresiei singure, aceste afecțiuni nu ar fi de așteptat.
Depresia este adesea un diagnostic pus pe baza simptomelor și a istoricului medical. Funcția tiroidiană scăzută este diagnosticată cu ajutorul unui examen fizic și al testelor de sânge. Pentru a vedea dacă există o legătură între depresie și funcția tiroidiană, medicul dumneavoastră poate solicita aceste teste pentru un diagnostic definitiv.Dacă depresia dumneavoastră este cauzată doar de hipotiroidism, corectarea hipotiroidismului ar trebui să trateze depresia. În caz contrar, medicul dumneavoastră vă poate prescrie medicamente pentru ambele afecțiuni.
Vă va ajusta încet dozele până când depresia și hipotiroidismul vor fi sub control.
Care este legătura dintre hipotiroidism și anxietate?În timp ce hipotiroidismul a fost asociat de mult timp cu depresia, un studiu din 2016 indică faptul că ar putea fi asociat și cu anxietatea.
Cercetătorii au evaluat 100 de persoane cu vârste cuprinse între 18 și 45 de ani care au un istoric cunoscut de hipotiroidism. Folosind un chestionar de anxietate, au descoperit că aproximativ 63% dintre ei îndeplineau criteriile pentru o anumită formă de anxietate. Cercetările de până acum au constat în studii mici. Studii mai mari și mai concentrate asupra anxietății ar putea ajuta la determinarea dacă există o legătură reală între hipotiroidism și anxietate. Este important ca tu și medicul tău să discutați despre toate simptomele tale atunci când ești evaluat pentru afecțiuni tiroidiene.
Care este efectul hipotiroidismului asupra sarcinii?Femeile care au hipotiroidism și doresc să rămână însărcinate se confruntă cu un set special de provocări. Funcția tiroidiană scăzută sau hipotiroidismul necontrolat în timpul sarcinii poate provoca:
anemie
avort spontan
preeclampsie
greutate mică la naștere
probleme de dezvoltare a creierului
defecte la naștere
Dacă aveți hipotiroidism și sunteți însărcinată, este important să luați următoarele măsuri în perioada în care așteptați:
Discutați cu medicul dumneavoastră despre testareFemeile pot dezvolta hipotiroidism în timp ce sunt însărcinate. Unii medici verifică în mod obișnuit nivelul tiroidei în timpul sarcinii pentru a monitoriza dacă există niveluri scăzute de hormoni tiroidieni. Dacă nivelurile dvs. sunt mai scăzute decât ar trebui să fie, medicul dvs. poate sugera un tratament. Unele femei care nu au avut niciodată probleme tiroidiene înainte de a fi însărcinate le pot dezvolta după ce au un copil. Acest lucru se numește tiroidită postpartum. Pentru multe femei, afecțiunea se rezolvă în decurs de 12 până la 18 luni, iar medicația nu mai este necesară. Aproximativ 20 la sută dintre femeile cu tiroidită postpartum vor ajunge să aibă nevoie de tratament pe termen lung.
Rămâneți la zi cu medicația dvs.
Continuați să vă luați medicamentele așa cum v-au fost prescrise.
Este obișnuit să faceți teste frecvente, astfel încât medicul dumneavoastră să poată face ajustările necesare la medicația tiroidiană pe măsură ce sarcina avansează. Acest lucru asigură faptul că bebelușul primește suficient hormon tiroidian pentru dezvoltarea organelor.
Mâncați bine
Corpul tău are nevoie de mai multe substanțe nutritive, vitamine și minerale în timp ce ești însărcinată. Consumul unei diete bine echilibrate și administrarea de multivitamine în timpul sarcinii vă poate ajuta să mențineți o sarcină sănătoasă.
Concluzia
Femeile cu probleme tiroidiene pot avea și foarte des au sarcini sănătoase
Sursa: